- TOP
- 理解する
理解する
肺NTM症とは?
〜疫学・感染経路・疾患経過〜
- 肺NTM症は、非結核性抗酸菌(nontuberculous mycobacteria:NTM)を原因菌として発症する呼吸器感染症です1)。
- 近年、本邦では肺NTM症が急増しており2-3)、日常診療でも遭遇する機会が増えています。
- NTMは180種以上が知られていますが、本邦の肺NTM症の原因菌の約90%はMycobacterium avium complex(MAC)が占めています2-3)。
- 病初期は無症状のことも多く、一般的には緩徐に進行しますが、経過は患者によりさまざまです4)。
- 無治療のまま放置すると、最終的には多くの患者が呼吸不全に至り、死亡するケースもあります。厚生労働省の人口動態調査(2022年)では、年間2,360人がNTM症により死亡し、このうち1,158人が肺NTM症による死亡であったことが報告されています5)。
疫学
日常診療で
肺NTM症患者さんに遭遇する機会
が増えています
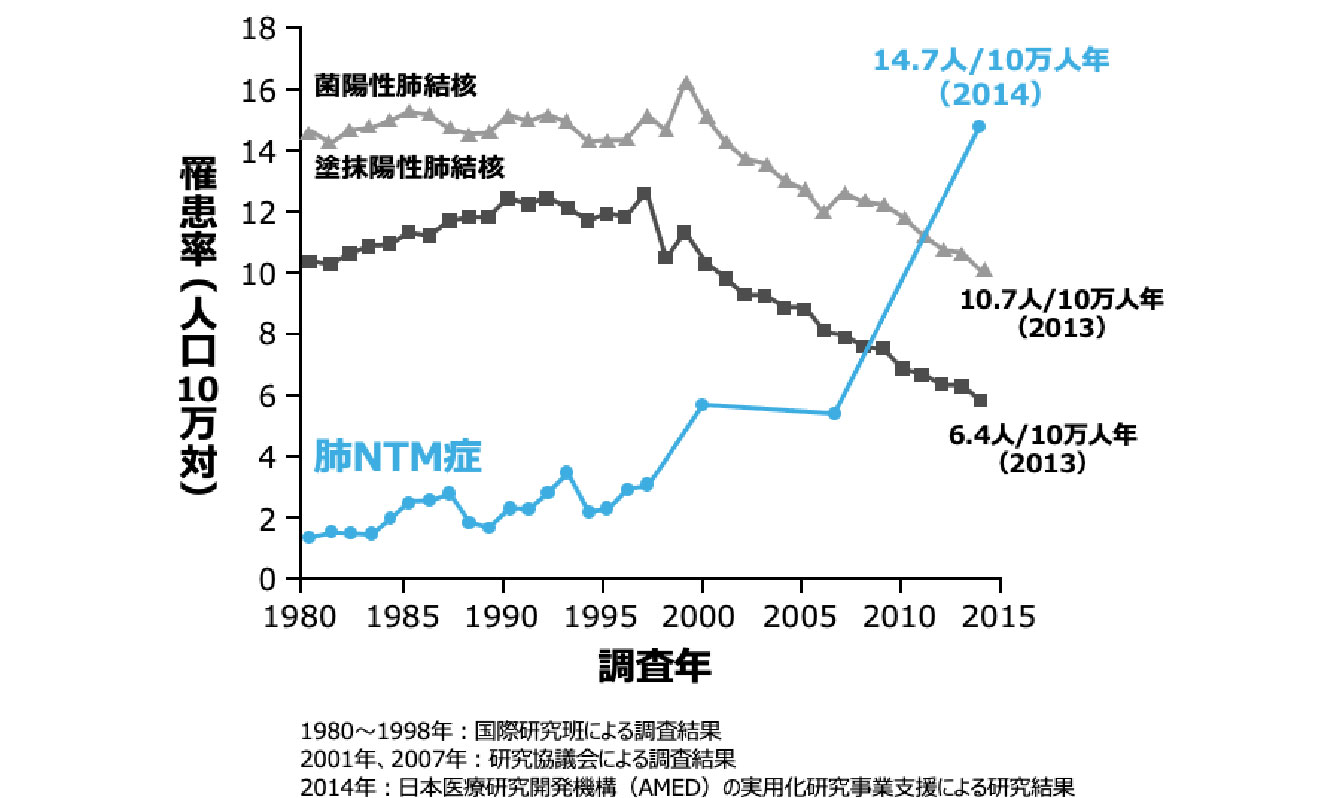
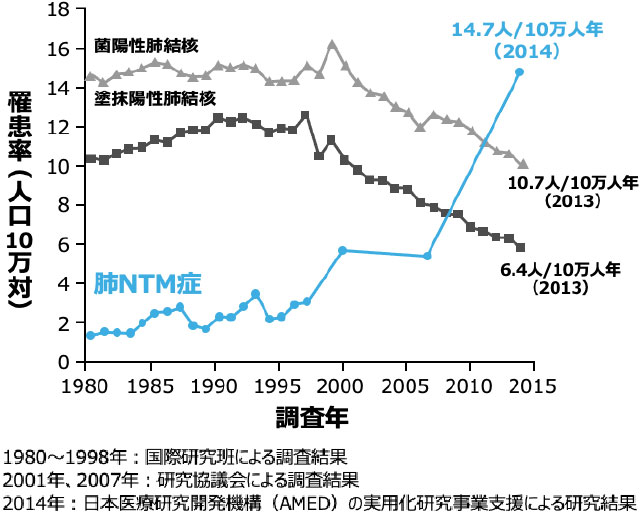
肺NTM症の罹患率の推移
- 肺NTM症は、非結核性抗酸菌(nontuberculous mycobacteria:NTM)を原因菌として発症する呼吸器感染症です。近年、本邦の肺NTM症患者は急激な増加傾向にあり、日常診療でも遭遇する機会が増えていると考えられます。
- 2014年の全国調査における肺NTM症罹患率は肺結核を上回る14.7人/10万人年と報告されており、2007年と比べると約2.6倍に増加しました 図1 2-3)。
肺NTM症患者の発症年齢と性別
- 本邦の肺NTM症の罹患率は、男性よりも女性の方が高く、加齢とともに上昇します 図2 6)。
- 男女ともに40歳代以降に急激に増加し、80歳以上の年齢層を除くと全年代層で女性の方が高率です6)。男性は、高齢層での発症が特に多いという特徴があります 図2 6)。
年齢/男女別の肺NTM症罹患率(2011年)
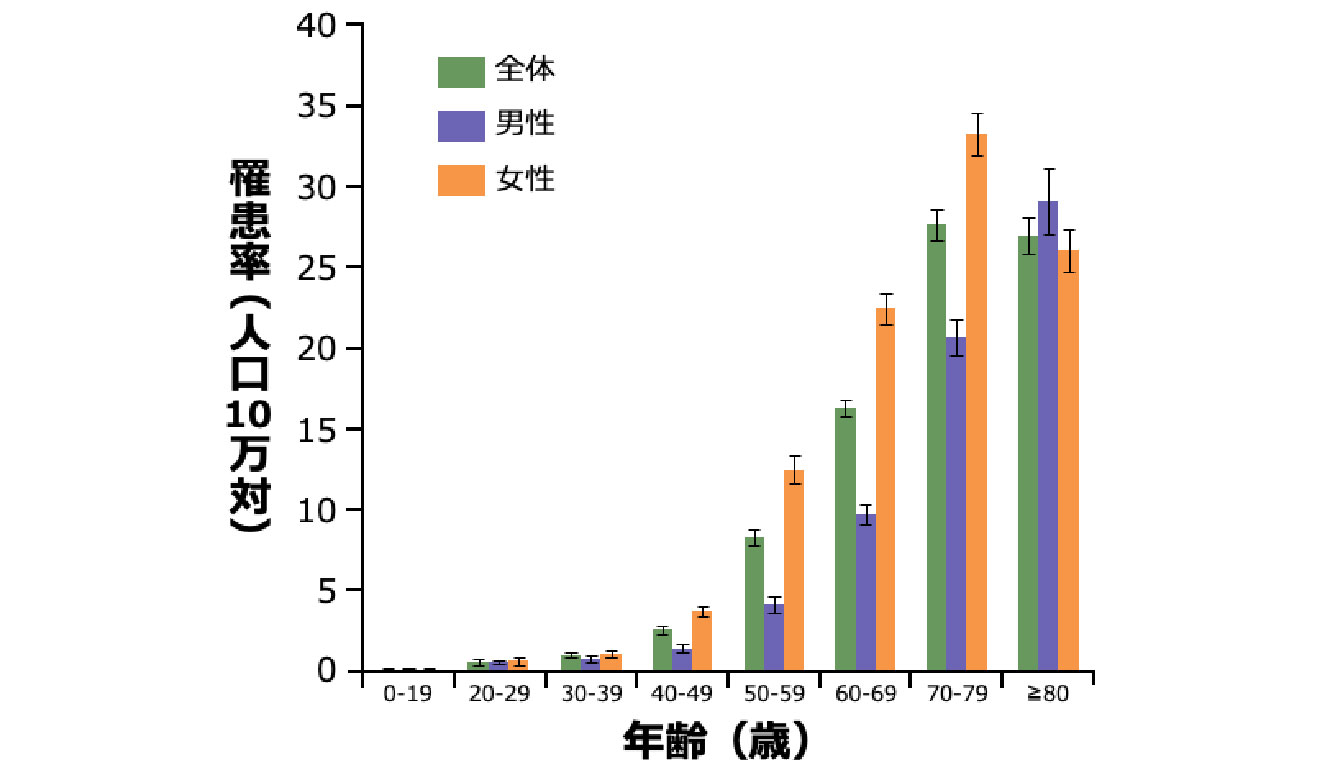
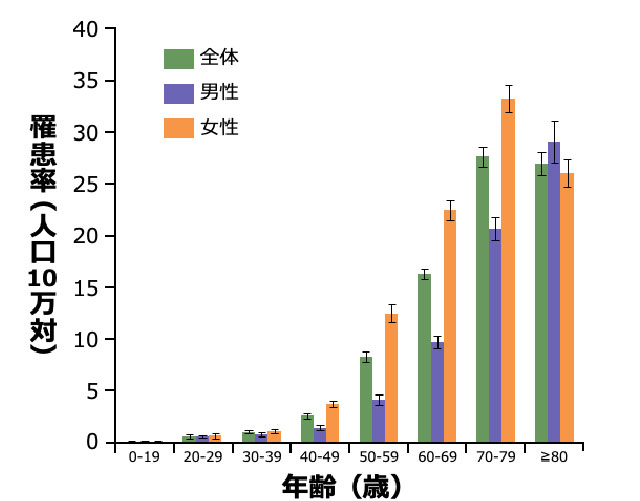
対象・方法:2009~2014年に収集された全国のレセプト情報から、対象期間に肺NTM症と診断された約37万人分のレセプト情報を解析した。
Adapted with permission of the American Thoracic Society.
Copyright © 2020 American Thoracic Society. All rights reserved.
Izumi K, Morimoto K, Hasegawa N, et al. 2019. Epidemiology of Adults and Children Treated for Nontuberculous Mycobacterial Pulmonary Disease in Japan. Ann Am Thorac Soc. 16(3): 341-347.
Annals of the American Thoracic Society is an official journal of the American Thoracic Society.
Readers are encouraged to read the entire article for the correct context at https://www.atsjournals.org/doi/10.1513/AnnalsATS.201806-366OC.
The authors, editors, and The American Thoracic Society are not responsible for errors or omissions in adaptations.
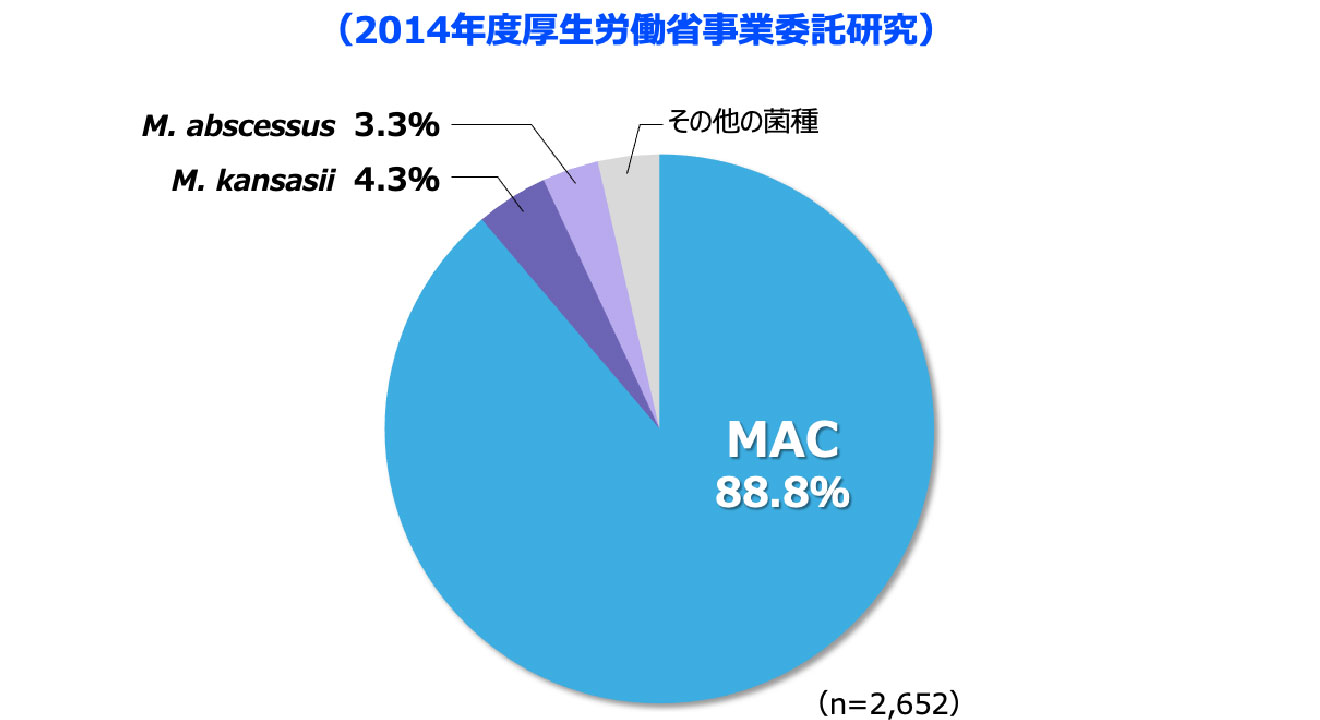
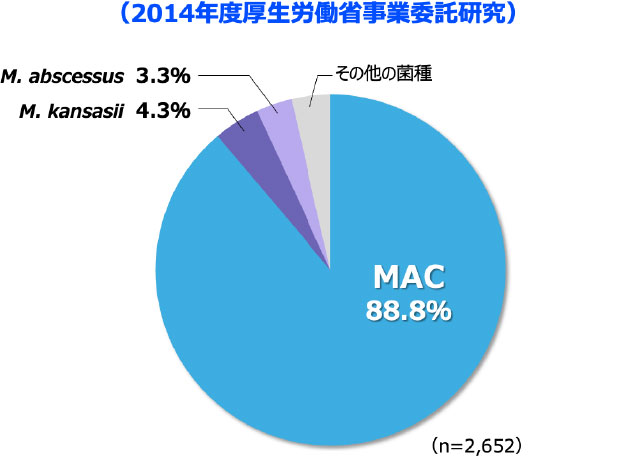
NTMとは
日本では
肺NTM症の約90%が
MACによるものです
- NTMは、結核菌群とらい菌群を除いた抗酸菌の総称で、現在、180種以上が確認されています7-9)。
- しかし、国内の肺NTM症の原因菌種は限られており、Mycobacterium avium(M. avium)、Mycobacterium intracellulare(M. intracellulare)、Mycobacterium kansasii(M. kansasii )、Mycobacterium abscessus(M. abscessus)の4菌種がほとんどです2)。
- 2014年の全国調査において、肺NTM症の原因菌種として最も高頻度であったのはM. aviumとM. intracellulareを総合したMycobacterium avium complex(MAC)*で、88.8%を占めました 図3 2-3)。
- 肺NTM症の経過と治療法は、原因菌種により異なります。菌種によっては病原性や治療反応性が全く異なることもあるため10-11)、治療には菌種同定が必須になります。
*M. aviumとM. intracellulareは性状や病気のタイプが似ており、一括してMACと呼ばれている。
NTMの生息環境
NTMは
環境中に広く常在しています
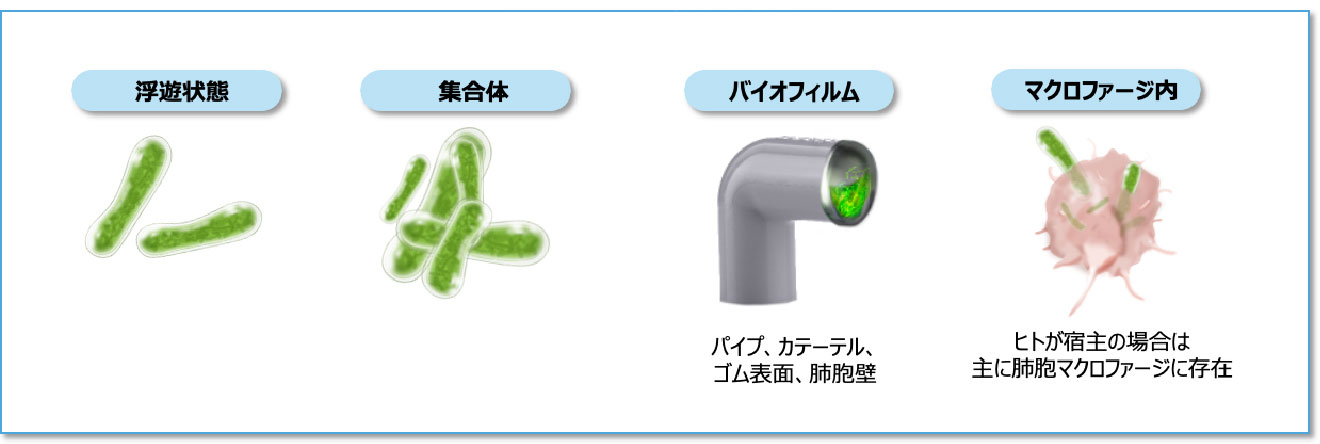
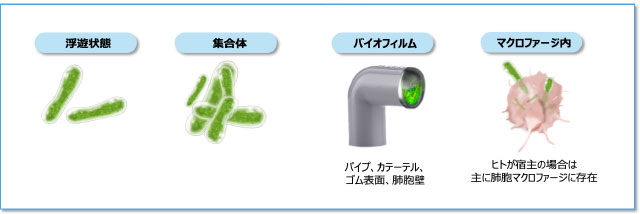
NTMの生息環境と生息様式
- NTMは、土壌や水系などの自然環境および水道や浴室などの給水にかかわる生活環境に広く生息している環境細菌です1)。
- NTMは生きた細胞内に寄生して増殖する細胞内寄生菌ですが、生存には必ずしも細胞内寄生が必要なわけではありません11-12)。さらにNTMの多くは、増殖に特殊な栄養源を必要としないため、さまざまな環境に適応して長く生存することができます12-13)。
- ヒト体内では主に肺胞マクロファージに取り込まれやすく、自然環境中では主にバイオフィルムを形成して存在します 図4 14)。バイオフィルムを形成することで、消毒薬や抗菌薬に抵抗性を示すとともに、低酸素、低栄養など厳しい環境下でも生存できるようになります14-15)。
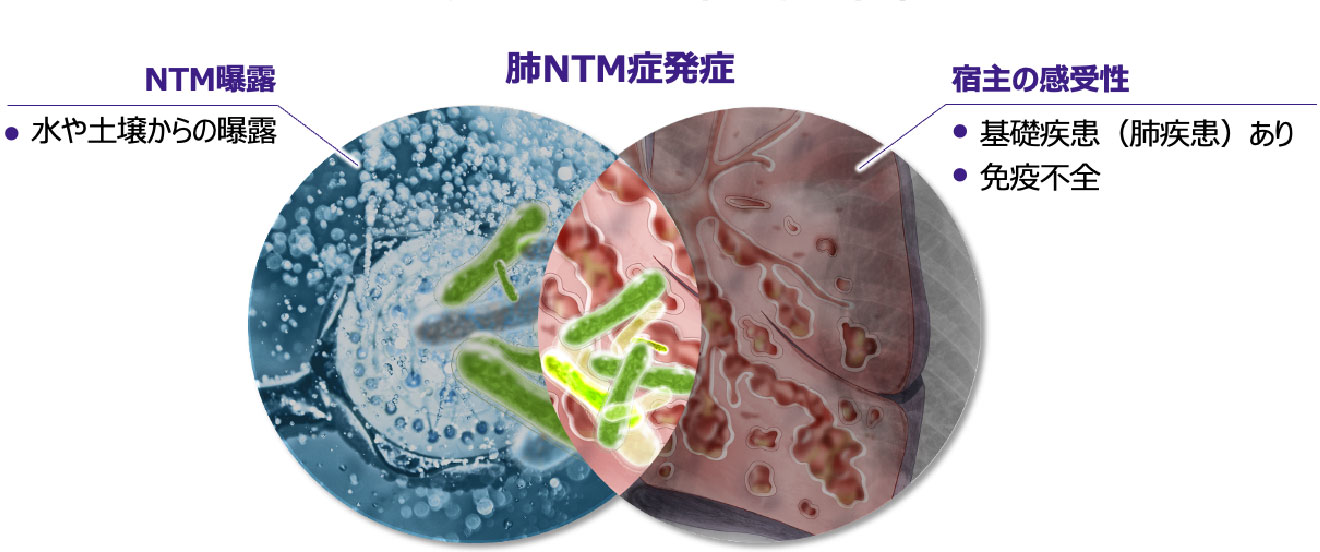
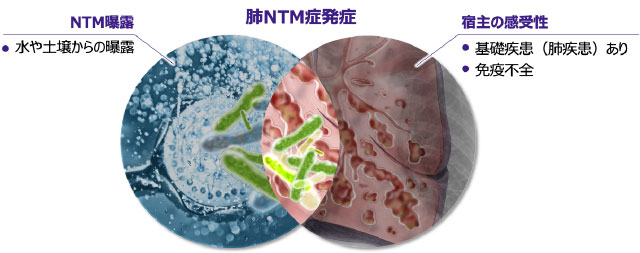
NTMへの曝露から発症への進展
- NTMは環境中に多く存在していますが、実際には曝露を受けても必ずしも発症しないことから、発症には宿主側の要因が大きいと考えられます16-17)。
- 一般に肺NTM症は、肺の何らかの構造変化を受けた部位(肺結核後遺症、慢性間質性肺炎、気管支拡張症など)にNTMが定着し、さらに宿主側の要因が加わることで発症すると考えられます4)。
- 肺NTM症を発症していなくても体内にNTMが定着しているケースがありますが、基礎疾患としての肺疾患や免疫能の低下がある場合には宿主の感受性が高まり、肺NTM症を発症しやすくなります 図5 16-17)。
再感染・コンタミネーション
の危険性
- 肺NTM症では、いったんNTM感染が陰性化した後に、環境中のNTMから新たに感染が起こる再感染はまれではありません18)。
- また、環境中に広く常在することから、検査室などでもコンタミネーションの危険性があることに注意が必要です19)。
感染経路・感染部位
NTMの主な感染部位は肺です
- 一般にNTMではヒト-ヒト感染は起こりません19)。ヒトへの感染経路は、NTMが生息する環境からの感染と考えられます。
- NTMのヒトへの主な感染経路には、生活環境のなかでのエアロゾルへの曝露、外傷などがあります 図6 12, 20)。
NTMの主な感染経路
※タップすると画像が拡大します
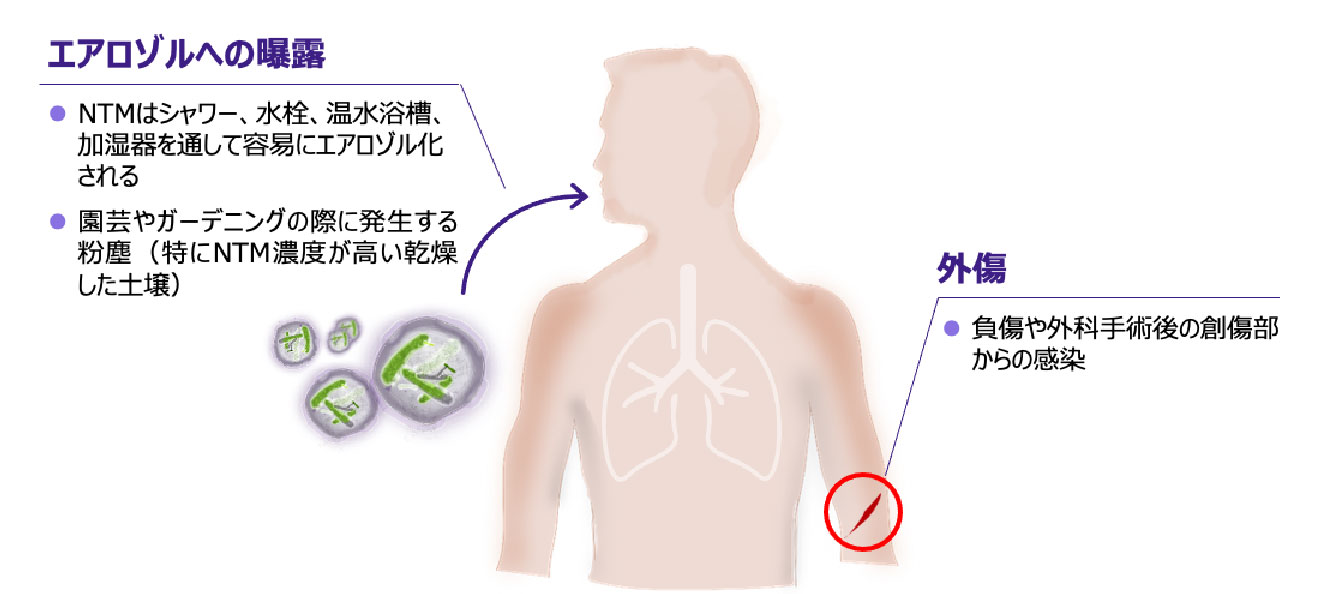
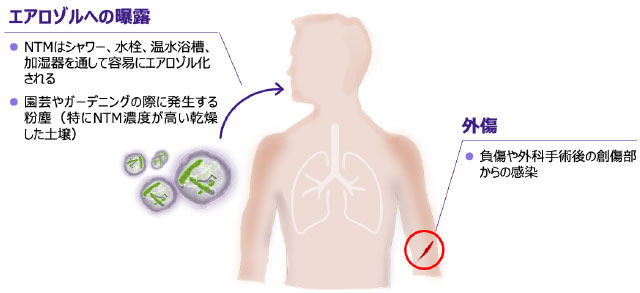
Falkinham JO Ⅲ. Clin Chest Med. 2015; 36(1): 35-41.、 Falkinham JO Ⅲ. J Appl Microbiol. 2009; 107(2): 356-367. より作成
- NTMは皮膚軟部組織、骨、頸部リンパ節や全身(播種性)など、人体のさまざまな部位にNTM感染症を引き起こしますが21)、感染頻度が最も高い部位は肺です22)。
- 肺NTM症は、NTMを含むエアロゾルに曝露されてNTMが気道へと入り込み、そこからさらにNTMが細胞内へと侵入し、肺胞内でマクロファージに侵入して生体防御機構を破壊することで発症すると考えられます23-26)。
疾患の経過
肺NTM症を無治療で放置すると
進行し重篤化することも
- 肺NTM症は一般的には緩徐に進行しますが、臨床経過は患者によって異なります。無治療でも長期間悪化しないケースがある一方、海外の後ろ向き研究では、無治療で経過観察した肺MAC症患者の62.5%(305/488例)は、診断後3年以内に治療開始を要する悪化をきたしたことが報告されています27)。また、治療を受けても進行する予後不良なケースもあります4)。
- 無治療のまま放置すると最終的には多くの患者が呼吸不全に至る難治性疾患です。重症化すると死亡に至ることもあります4)。罹患率の増加とともに死亡数も増加しており、2018年の厚生労働省の人口動態調査では、年間1,980人がNTM症により死亡し、このうち1,019人が肺NTM症により死亡していたことが報告されています5)。
- また、治療が成功しても、環境中から新たにNTMに感染し再発すること(再感染)や18)、肺病変の中に残存していたNTMが再度増殖して再発すること(再燃)もあり、治療後も再発に注意が必要です 表1 28)。
肺NTM症の再発
- 再感染
- 環境中のNTMから新たに感染して再発する
- 再燃
- 肺病変の中に残存していたNTMが再度増殖して再発する
中川拓, 小川賢二. 呼吸器ジャーナル. 2018;66(4): 608-615. より作成
REFERENCES
- 佐々木結花 編. 結核・非結核性抗酸菌症を日常診療で診る. 羊土社; 2017.
- Namkoong H, et al. Emerg Infect Dis. 2016;22(6): 1116-1117.
- 日本医療研究開発機構. プレスリリース:呼吸器感染症を引き起こす肺非結核性抗酸菌症の国内患者数が7年前より2.6倍に増加―肺結核に匹敵する罹患率―. https://www.amed.go.jp/news/release_20160607-02.html (2020年7月20日に利用)
- 日本結核病学会 編. 非結核性抗酸菌症診療マニュアル. 医学書院; 2015.
- 政府統計の総合窓口e-Stat. 人口動態調査 / 人口動態統計 確定数 死亡(2022年). https://www.e-stat.go.jp/stat-search/files?page=1&layout=datalist&toukei=00450011&tstat=000001028897&cycle=7&year=20220&month=0&tclass1=000001053058&tclass2=000001053061&tclass3=000001053065&stat_infid=000040098339&result_back=1&tclass4val=0 (2023年9月19日に利用)
- Izumi K, et al. Ann Am Thorac Soc. 2019;16(3): 341-347.
- Fedrizzi T, et al. Sci Rep. 2017;7: 45258.
- Gupta RS, et al. Front Microbiol. 2018;9: 67.
- Philley JV, et al. Thorac Surg Clin. 2019;29(1): 65-76.
- Weiss CH, Glassroth J. Expert Rev Respir Med. 2012;6(6): 597-612.
- Stout JE, et al. Int J Infect Dis. 2016;45: 123-134.
- Falkinham JO III. Clin Chest Med. 2015;36(1): 35-41.
- Falkinham JO III. Curr Environ Health Rep. 2016;3(2): 161-167.
- Chakraborty P, Kumar A. Microb Cell. 2019;6(2): 105-122.
- Faria S, et al. J Pathog. 2015;2015: 809014.
- Daley CL. Microbiol Spectr. 2017;5(2): doi: 10.1128/microbiolspec.TNMI7-0045-2017.
- Mirsaeidi M, et al. Eur J Intern Med. 2014;25(4): 356-363.
- Wallace Jr RJ, et al. Am J Respir Crit Care Med. 1998;158(4): 1235-1244.
- 鈴木克弘. 日内会誌. 2011:100(4): 1058-1066.
- Falkinham JO III. J Appl Microbiol. 2009;107(2): 356-367.
- Baldwin SL, et al. PLoS Negl Trop Dis. 2019;13(2): e0007083.
- Zhang ZX, et al. BMC Infect Dis. 2019;19(1): 436.
- Ganbat D, et al. BMC Pulm Med. 2016;16: 19. doi: 10.1186/s12890-016-0185-5.
- McGarvey J, Bermudez LE. Clin Chest Med. 2002;23(3): 569-583.
- Honda JR, et al. Clin Chest Med. 2015;36(1): 1-11.
- Matsuyama M, et al. Am J Respir Cell Mol Biol. 2018;58(2): 241-252.
- Hwang JA, et al. Eur Respir J. 2017; 49(3): 1600537.
- 中川拓, 小川賢二. 呼吸器ジャーナル. 2018;66(4): 608-615.